Afbeelding 1. James Franck en Gustav Hertz.Afbeelding: Nobel Foundation.
In 1911 begonnen James Franck en Gustav Hertz een samenwerking om botsingen tussen langzame elektronen (beduidend trager dan de lichtsnelheid) en gasmoleculen te bestuderen. Dit leidde tot een experiment in 1914 waarbij ze zulke elektronen afschoten op kwikdampatomen. Het resultaat: de elektronen bleken bij de botsingen alleen een heel specifieke hoeveelheid van hun bewegingsenergie kwijt te kunnen raken – 4,9 elektronvolt, om precies te zijn. Een elektron dat een beginsnelheid heeft van zo’n 1,3 miljoen meter per seconde (‘langzaam’ vergeleken met de lichtsnelheid van 300 miljoen meter per seconde) komt daardoor tot stilstand. Een elektron dat sneller gaat, verliest precies 1,3 miljoen meter per seconde aan snelheid; een elektron dat langzamer gaat ketst af zonder te vertragen.
De experimentele opstelling bestond uit een buis met daarin (in vacuüm) een verdampte druppel kwik en drie elektrodes: een kathode, een metalen rooster, en een anode. De hete kathode zendt elektronen uit, die worden aangetrokken door het rooster, dat daartoe op een hogere spanning is gebracht dan de kathode. Als de elektronen door dat metalen rooster gaan en daarna de anode bereiken (die dan weer op een iets lager voltage wordt gehouden dan het rooster), ontstaat een gesloten stroomkring en wordt dus een stroompje gemeten. Toen Franck en Hertz het spanningsverschil tussen de kathode en het rooster lieten oplopen, zagen ze in eerste instantie een evenredig toenemende stroom. Zodra het spanningsverschil echter 4,9 elektronvolt werd, viel de stroomsterkte terug: de kwikatomen in de damp moesten dus wel de elektronen zodanig hebben afgeremd, dat die de anode niet meer konden bereiken.
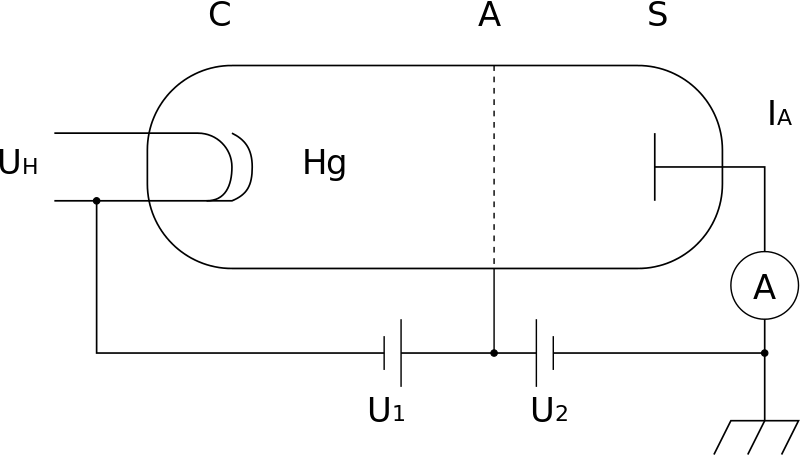
Afbeelding 2. De opstelling.De experimentele opstelling van het experiment. Links de kathode, in de buis kwikdamp (Hg) en het rooster (de stippellijn), en rechts de anode. Tussen U1 en U2 wordt een stroom gemeten als de elektronen door het rooster gaan. Afbeelding: Sebastian Wagner.
Franck en Hertz verklaarden hun resultaten als volgt. Zij stelden dat voor langzame elektronen – met een snelheid onder de 1,3 miljoen meter per seconde – de botsing met het kwikatoom elastisch is: het elektron ketst af op het (veel zwaardere) kwikatoom zonder snelheid te verliezen. Het kwikatoom blijft daarbij onveranderd. Als het elektron sneller gaat dan 1,3 miljoen meter per seconde wordt de botsing inelastisch: het kwikatoom neemt kinetische energie over van het elektron, dat daardoor snelheid verliest, en raakt ‘aangeslagen’. Even later zendt het kwikatoom licht uit met een golflengte van 254 nanometer. Die golflengte komt precies overeen met de excitatie-energie (de energie die nodig is om de toestand aan te slaan) die ook Einstein in 1905 gebruikte voor zijn beschrijving van het foto-elektrisch effect. Op 24 april 1914 presenteerden James Franck en Gustav Hertz hun gezamenlijke bevindingen aan de Deutsche Physikalische Gesellschaft.
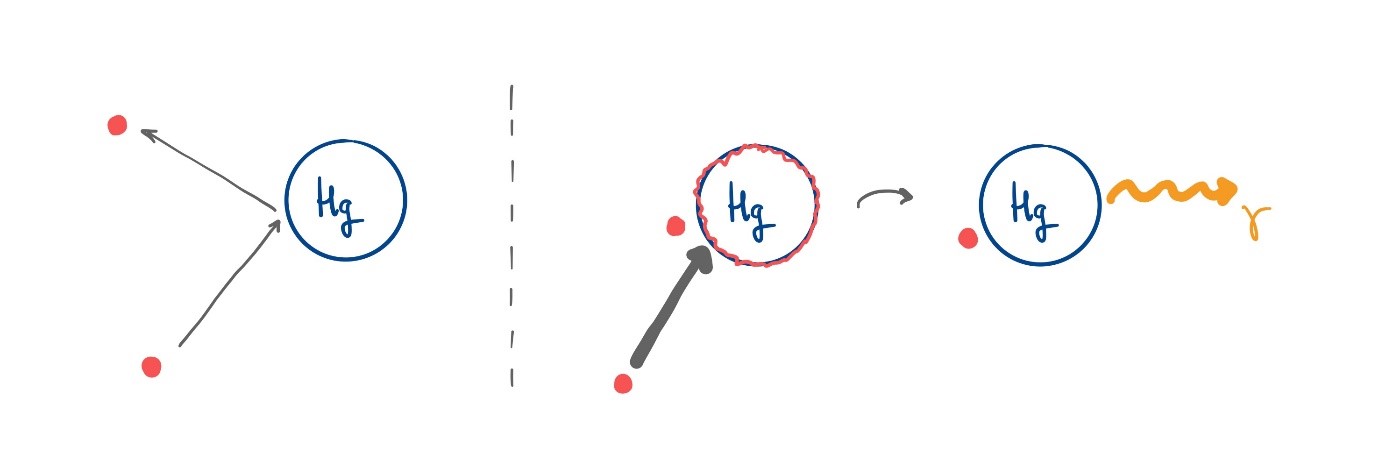
Afbeelding 3. Elastisch en inelastisch.De verklaring van Franck en Hertz. Links een elastische botsing, waarbij het langzame elektron alleen van richting verandert. Rechts een inelastische botsing: het elektron heeft nu meer energie (aangegeven door de dikke pijl) en komt tot stilstand. Het kwikatoom raakt aangeslagen en zendt even later een foton uit.
Wat zij echter niet wisten was dat een jaar eerder, in 1913, Niels Bohr zijn atoommodel had gepubliceerd. Volgens dat model kunnen elektronen alleen in heel specifieke banen om de atoomkern heen draaien. Eigenlijk is dat ‘draaien’ ook niet helemaal de juiste beschrijving, en moet je de elektronen eerder zien als golven die om de atoomkern heen bewegen. Zo’n golf moest volgens Bohrs model precies ‘passen’ op de baan. Om naar een hogere baan te springen, hebben de elektronen daarom een eveneens heel specifieke hoeveelheid energie nodig: het verschil in energie tussen de nieuwe en de oude baan. Volgens Bohr kon een elektron in zo’n aangeslagen toestand komen door bijvoorbeeld een foton op te nemen. Andersom kan een elektron terugvallen naar een lagere baan door precies dat verschil in energie uit te zenden in de vorm van een foton (een lichtdeeltje) van die energie.
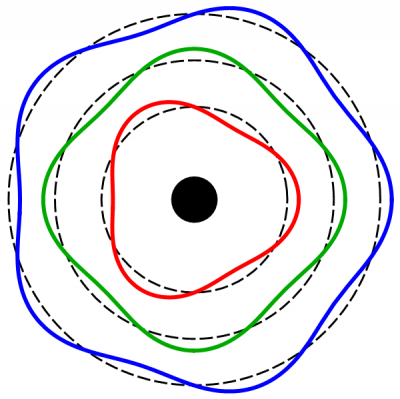
Afbeelding 4. Het model van Bohr.In Bohrs atoommodel zijn de enige toegestane “banen” van elektronen de golven waarvan de golflengte precies een geheel aantal malen rond de kern past.
Toen Bohr de resultaten van Franck en Hertz zag, realiseerde hij zich dat die verklaard konden worden door zijn atoommodel: de 4,9 eV is precies zo’n energieverschil tussen twee elektronbanen bij een kwikatoom. Dat verklaarde, op een natuurlijker manier dan de plotse overgang tussen elastische en inelastische botsingen, waarom alleen op dat spanningsverschil de stroom terugliep: alleen met die specifieke energie kon een elektron het atoom aanslaan en zelf energie verliezen. Het verklaarde ook waarom even later licht werd uitgezonden van een specifieke golflengte: dat was het terugvallen van het aangeslagen elektron naar diens oorspronkelijke baan.
In 1915 publiceerde Bohr een artikel waarin hij de relatie uitlegde tussen het Franck-Hertz experiment en zijn eigen atoommodel. Inmiddels wordt het Franck-Hertz experiment inderdaad gezien als het eerste directe bewijs van Bohrs atoommodel – en in 1925 kregen Franck en Hertz daar welverdiend de Nobelprijs voor de Natuurkunde voor.