
In dit artikel wil ik wijzen op een opmerkelijke eigenschap van ijs, die ik een tijdje geleden zelf bestudeerd heb in het lab aan de Universiteit van Amsterdam. Neem daarvoor twee ijsklontjes, leg ze in de vriezer op elkaar, en kijk een uur later of je ze nog van elkaar af kunt halen. Het antwoord is: nee, dit gaat niet. Dit plakkende fenomeen trok zo’n 160 jaar geleden de aandacht van de op dat moment zeer gerespecteerde natuurkundige, Michael Faraday. In een van zijn bekende kerstlezingen sprak Faraday over het “sintering-effect” van ijs. Zijn conclusie was dat er zich aan de buitenkant van een ijsblokje altijd een dun laagje water bevindt, zelfs als je het bewaart bij een temperatuur ver onder 0 °C. Wanneer je dan twee ijsblokjes op elkaar legt bevriest dit laagje, wat ervoor zorgt dat je ze niet meer van elkaar krijgt.
Het duurde ongeveer honderd jaar voordat wetenschappers de claim van de grote Faraday durfden tegen te spreken. Men ontdekte dat moleculen aan het oppervlak van ijs losser gebonden zijn dan midden in het kristal. Hierdoor kost het relatief weinig energie om die moleculen over het oppervlak te bewegen, of zelfs los te maken. Drie nieuwe theorieën werden geopperd die mogelijk het sinteren van ijs correct beschrijven. Een debat in de ijswereld, tussen aanhangers van de volgende vier verklaringen, was geboren:
- Het immer presente, dunne laagje water van Faraday
- De mogelijkheid voor moleculen aan het oppervlak van ijs om te sublimeren (van vast gasvormig te worden) en vervolgens te condenseren
- Het voorkomen van watermoleculen die zich binnen in het ijskristal (bulk) herschikken tot een nieuw geheel
- De optie van watermoleculen die aan het oppervlak van het ijskristal posities wisselen, als een soort van schuifpuzzel
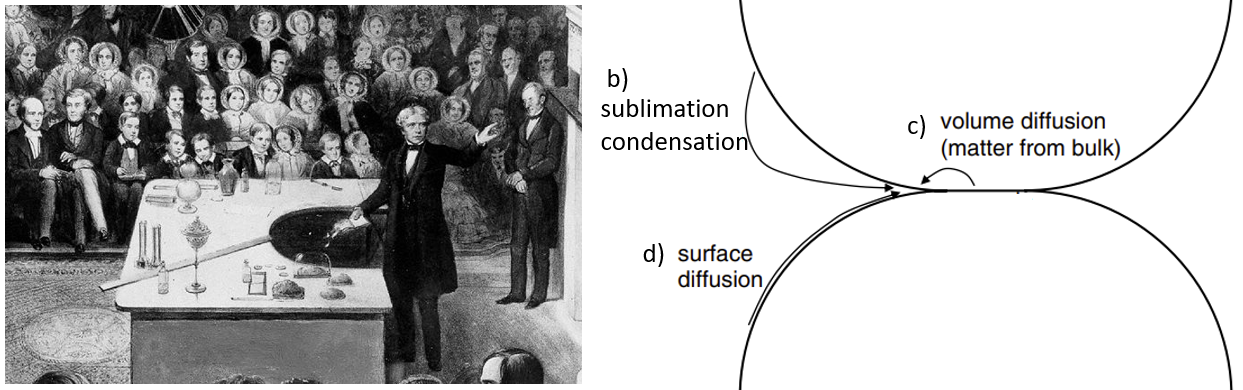
Welke theorie de juiste is zal ik nog even niet verklappen. Dit vraagstuk hebben we onderzocht in het laboratorium. Om dit onderzoek te doen maakten we gebruik van we een profilometer: een speciale microscoop die een reflecterend oppervlak tot op enkele nanometers nauwkeurig kan waarnemen.
Nu kun je de dynamiek van watermoleculen tussen twee ijsklontjes natuurlijk niet waarnemen met een microscoop. Daarom hebben wij een iets andere experimentele opstelling bedacht waarmee we de theorieën van hierboven konden testen. We nemen een vlijmscherp scheermes en maken een kleine snede in het ijs, om vervolgens de evolutie van deze kras waar te nemen. Wat blijkt: na een tijdsbestek van enkele uren is de kras verdwenen en heb je een perfect laagje ijs teruggekregen. Met andere woorden: het ijs heeft zichzelf ‘genezen’. In afbeelding 2 is goed te zien hoe een dergelijke snede in de loop van de tijd inderdaad verdwijnt.
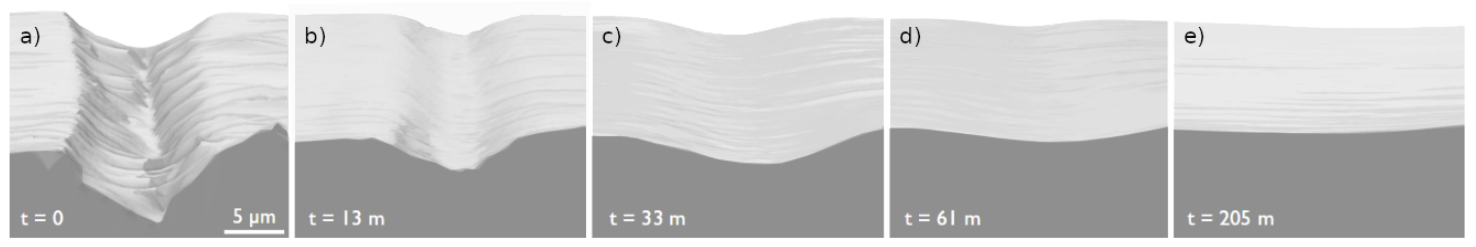
Een kras van 2,5 micrometer diep is ongeveer equivalent aan een diepte van 10.000 vaste watermoleculen. De beelden op zichzelf laten natuurlijk niet zien hoe de moleculen bewegen. Gelukkig hoeft dat ook niet om te testen wat de onderliggende natuurkunde is. We kunnen namelijk het profiel dat gemeten is op t = 0 benaderen met een Fourierreeks. In deze serie artikelen van Lieuwe Bakker kun je veel meer lezen over Fourierreeksen, maar het idee is in één zin samen te vatten als het wiskundig ontbinden van een lijn in een som van sinussen en cosinussen. Elke theorie die hierboven genoemd is heeft een karakteristieke tijdsevolutie, die we nu kunnen bekijken door met behulp van deze Fourieranalyse het golfkarakter van de snede te bestuderen als functie van de tijd.
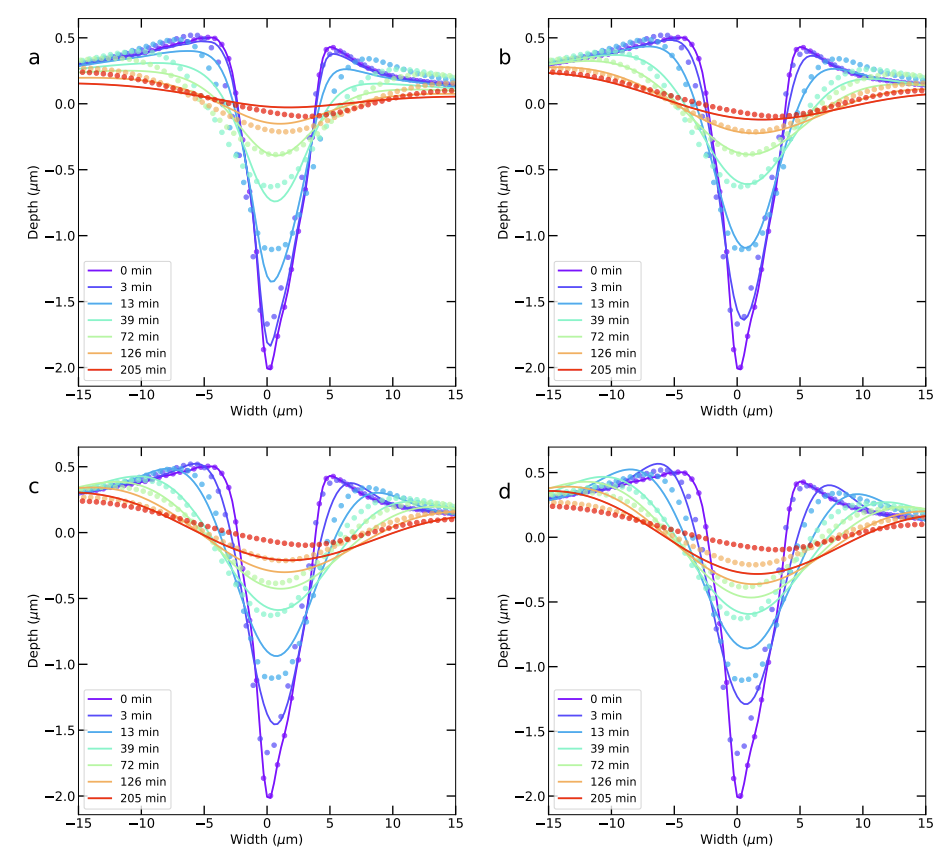
In afbeelding 3 zie je de vergelijking tussen de verschillende modellen en de metingen. De gestippelde lijn geeft steeds het gemeten profiel aan. De vaste lijn is een weergave van het model. De letters voor de profielen corresponderen met de eerdergenoemde modellen. Met het blote oog is het eindantwoord op de hoofdvraag van dit artikel al goed te zien. Paneel b), wat staat voor moleculen die zich in de gasfase door sublimatie en condensatie lokaal verplaatsen, lijkt het best te matchen. Deze verklaring wordt extra aannemelijk wanneer we ook nog het diepteverloop van de kras bekijken, zoals in afbeelding 4.
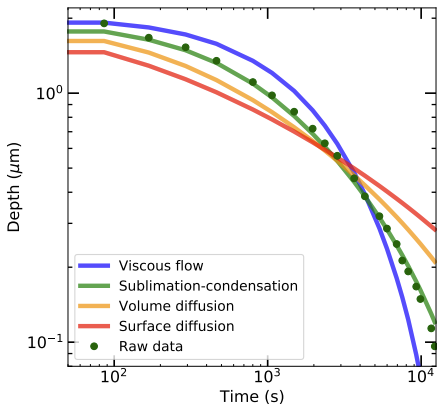
Door statistisch te testen bij 30 verschillende krassen, gemaakt in 6 verschillende ijstemperaturen, is met zekerheid vastgesteld dat inderdaad sublimatie-condensatie het mechanisme is dat het best overeenkomt met de werkelijkheid.
Dit resultaat heeft een paar grappige consequenties. Je zou bijvoorbeeld kunnen stellen dat een ijsbaan een perfect glad oppervlak heeft wanneer je deze een paar uur laat rusten. De enige kanttekening daarbij is dat je de dampdruk van het ijs en de lucht in evenwicht moet houden, zoals we in het experiment ook gedaan hebben. Anders zal je zien dat het vocht uit de lucht op het ijs zal condenseren, en dat maakt de baan juist weer slechter.
Je weet nu waarom je de ijsklontjes uit de vriezer niet meer van elkaar afkrijgt! IJs geneest zichzelf en ze groeien daardoor aan elkaar vast.
Vond je dit een leuk artikel, en wil je de gehele wetenschappelijke publicatie lezen? Die vind je via deze link.